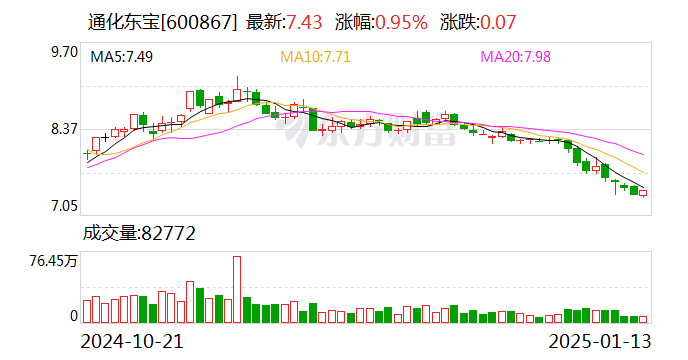
中证网讯(记者 宋维东)通化东宝1月13日晚公告称,公司全资子公司东宝紫星取得国家药品监督管理局药品审评中心(CDE)签发的关于注射用THDBH120减重适应症药物临床试验批准通知书后已开展II期临床试验,并于近日成功完成首例受试者给药。此举意味着该药物临床试验迈入深入研究阶段,并为后续开发研究提供可靠依据。
图片来源于网络,如有侵权,请联系删除
多重激动和长效协同作用是多肽减肥降糖药的主流研发趋势。注射用THDBH120是通化东宝重点在研的胰高血糖素样肽-1 (GLP-1) 受体和葡萄糖促胰岛素分泌多肽 (GIP) 受体双靶点激动剂,属于一类创新药。其将GLP-1和GIP这两种促胰岛素的作用整合至一个多肽单分子中,且通过分子设计进一步提高代谢稳定性,发挥协同促进的血糖控制、体重减轻以及调节脂质代谢等功能,满足单一分子靶点或复方制剂治疗效果不佳的糖尿病患者的临床需求,有望成为更长效的治疗糖尿病和肥胖的重磅药物。
图片来源于网络,如有侵权,请联系删除
2022年5月,全球首款GLP-1/GIP双受体激动剂——礼来公司研发的Tirzepatide糖尿病适应症产品(商品名:Mounjaro)获得美国FDA批准上市,其减重适应症产品(商品名:Zepbound)于2023年11月获得FDA批准上市。Tirzepatide为皮下注射给药,每周注射一次。
图片来源于网络,如有侵权,请联系删除
通化东宝此前进行的Ia期临床试验研究结果显示,注射用THDBH120安全性、耐受性良好,半衰期与同靶点产品Tirzepatide相比明显延长,充分支持一周给药一次并有望实现两周给药一次或更长给药间隔的用法。
此次注射用THDBH120完成减重适应症II期临床试验首例受试者给药,将为后续开发研究提供可靠依据。此外,“在中国肥胖受试者中评价注射用THDBH120多次给药的安全性、耐受性、药代动力学特征和初步有效性的随机、双盲、安慰剂对照的Ib期临床试验”正顺利开展,已完成数据库锁定。
值得一提的是,注射用THDBH120未来市场潜力巨大,其同类药品全球首款GLP-1/GIP双靶点受体激动剂——Tirzepatide上市后销售规模增长迅速。根据礼来公司定期财报,其Tirzepatide 2023年全球销售额为53.39亿美元(2022年为4.83亿美元),2024年前三季度全球销售额已达110.28亿美元。
通化东宝表示,公司将加速推进注射用THDBH120在减重适应症和糖尿病适应症领域的研发进度,进一步探索并挖掘其他适应症的潜力,实现产品价值最大化。