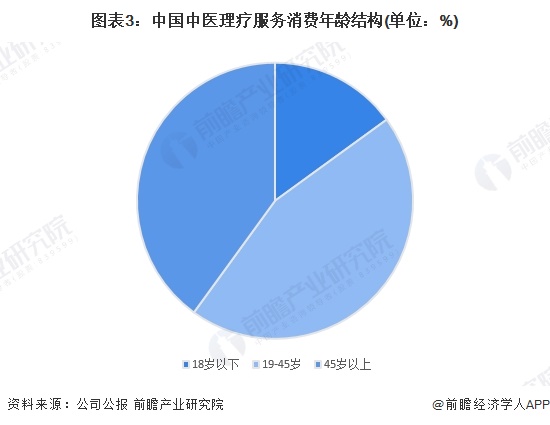
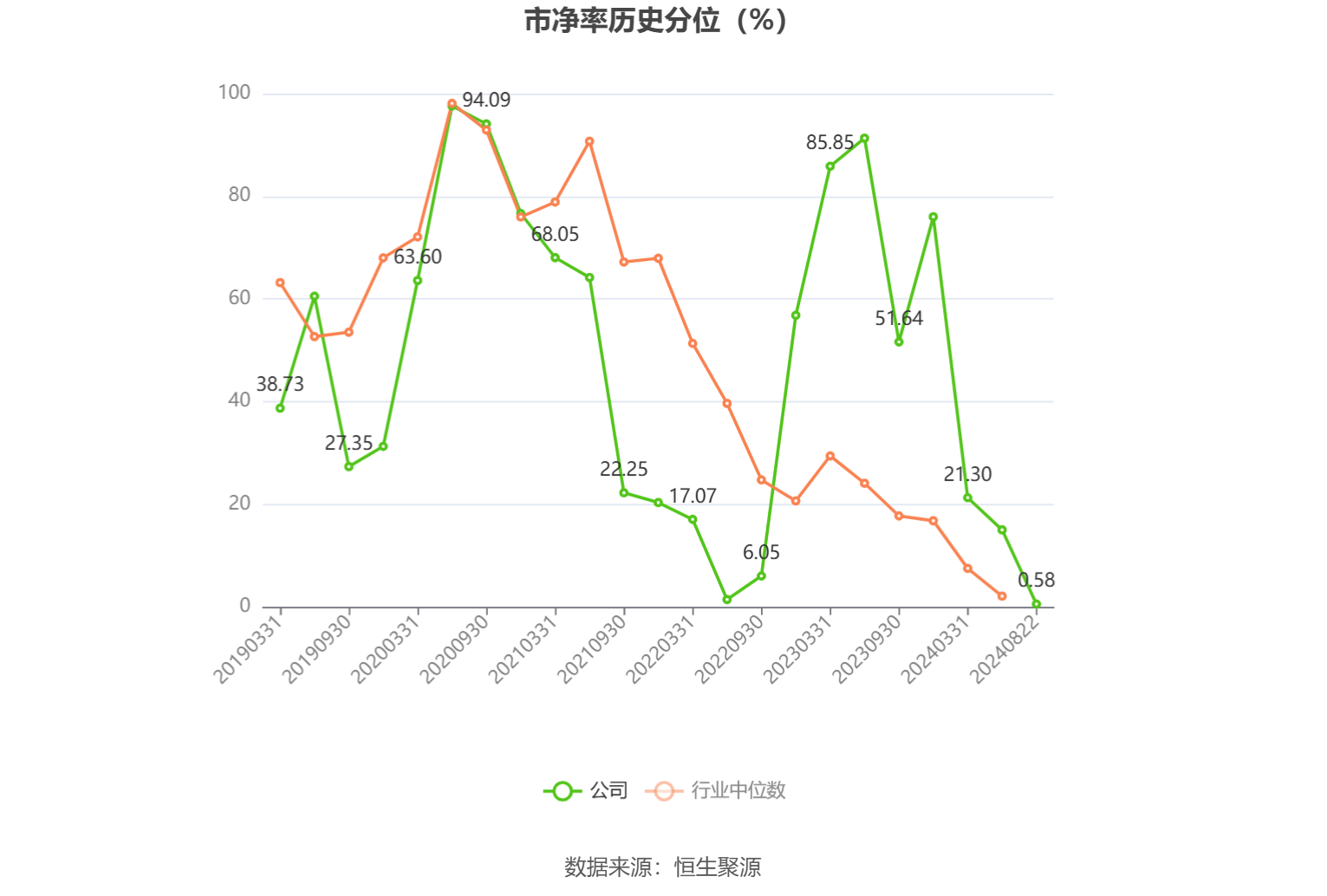
中证报中证网讯(记者 李梦扬)7月15日,云顶新耀宣布,其通用型的现货肿瘤治疗性疫苗EVM14注射液的新药临床试验申请(IND)获国家药品监督管理局药品审评中心(CDE)正式受理。这是该产品继2025年3月获美国食品药品监督管理局(FDA)批准开展临床后,在全球监管路径上的又一关键进展,该产品由此成为云顶新耀mRNA平台首个实现“中美双报”的产品,标志着公司在全球创新布局上又迈出了关键一步。
图片来源于网络,如有侵权,请联系删除
据介绍,EVM14注射液(简称“EVM14”)基于云顶新耀自主知识产权的mRNA技术平台研发,是一款靶向5个肿瘤相关抗原的通用型的现货肿瘤治疗性疫苗,拟用于鳞状非小细胞肺癌、头颈鳞癌等瘤种的治疗。

图片来源于网络,如有侵权,请联系删除
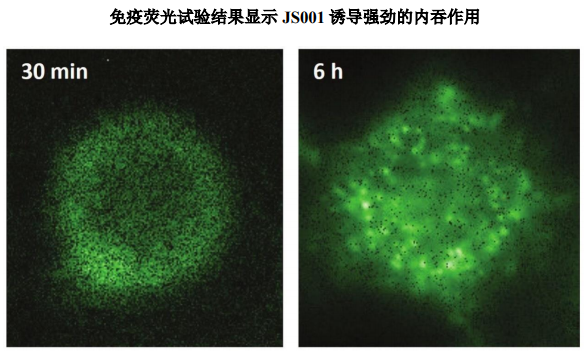
据公司介绍,作为云顶新耀首款自研mRNA肿瘤治疗性疫苗,EVM14在临床前研究中展现出较大治疗潜力。
为确保EVM14临床试验的顺利进行,云顶新耀已做好充分准备。2025年6月9日,云顶新耀嘉善工厂顺利放行首批GMP临床试验样品。这批样品将用于支持云顶新耀在中美两地开展EVM14的临床试验,合作的临床试验中心包括美国MD Anderson癌症中心和中国上海市胸科医院等。
在mRNA治疗领域,云顶新耀表示,公司前瞻性地布局了多款mRNA治疗药物,打造国际领先的、完全整合且成功经过临床验证的AI+mRNA平台,构建了一个涵盖从抗原设计、mRNA序列优化、LNP递送技术到规模化生产的端到端全产业链平台,实现了从靶点筛选、序列设计到递送优化以及生产的效率跃升。在今年6月底云顶新耀举办的“mRNA创新技术平台研发日”活动上,公司透露已与全球Top20药企建立广泛接洽,吸引多个跨国大型药企表达合作意向。
转载请注明:博客金融网 » 企业快讯 » 云顶新耀:EVM14注射液临床试验申请获国家药监局受理